什么是甲醇
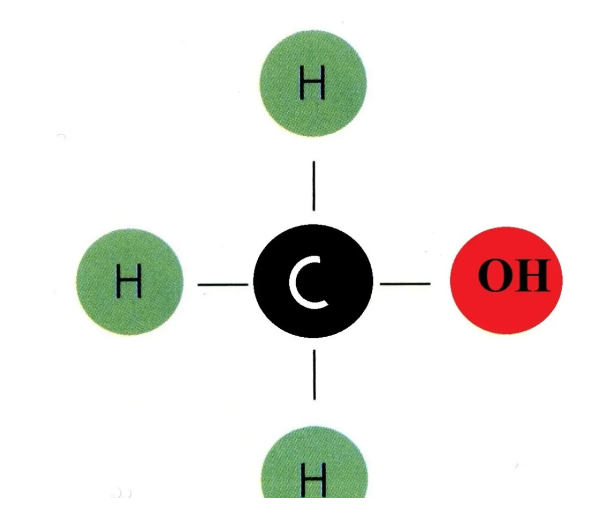
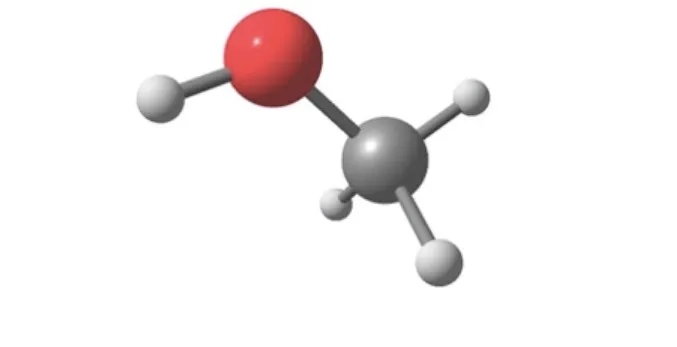
甲醇(Methanol)又称羟基甲烷、木醇(wood alcohol)或木精(wood spirits),是一种有机化合物,是结构最为简单的饱和一元醇,其化学式为CH3OH/CH4O。分子量为32.04,沸点为64.7℃。甲醇有“木醇”与“木精”之名,源自于曾经其主要的生产方式是自木醋液(为木材干馏或裂解的产物之一)萃取。现代甲醇是直接从一氧化碳,二氧化碳和氢的一个催化作用的工业过程中制造。甲醇很轻、挥发性强、无色、易燃,并有与乙醇(饮用酒)非常相似的气味。但不同于乙醇,甲醇毒性大,不可以饮用。通常用作溶剂、防冻剂、燃料或乙醇变性剂,亦可用于经过酯交换反应生产生物柴油。

古埃及人在遗体保存技术防腐的过程中,使用了包括甲醇的混合物质以保存尸体。然而,直到1661年,罗伯特·波义耳才首次分离出纯的甲醇,方法是蒸馏黄杨(黄杨木)。它后来被称为“pyroxylic spirit”。1834年,法国化学家让-巴蒂斯特·杜马和尤金·皮里哥确定了它的元素组成。在2006年,天文学家利用射电望远镜在焦德雷尔班克天文台的MERLIN阵列发现了太空中一个2.88亿英里宽的巨大甲醇云。
物理性质
1.性状:无色透明液体,有刺激性气味。
2.熔点(℃):-97.8
3.沸点(℃):64.7
4.相对密度(水=1):0.792
5.相对蒸气密度(空气=1):1.1
6.饱和蒸气压(kPa):12.3(20℃)
7.燃烧热(kJ/mol):-723
8.临界温度(℃):240
9.临界压力(MPa):7.95
10.辛醇/水分配系数:-0.82~-0.77
11.闪点(℃):12(CC);12.2(OC)
12.引燃温度(℃):464
13.爆炸上限(%):36.5
14.爆炸下限(%):6
15.溶解性:溶于水,可混溶与醇类、乙醚等多数有机溶剂。
16.折射率(n20ºC):1.3284
17.黏度(mPa·s,15ºC):0.6405
(mPa·s,20ºC):0.5945
(mPa·s,25ºC):0.5525
(mPa·s,30ºC):0.5142
18.闪点(ºC,开口):11[y1]
22.闪点(ºC,闭口):12.0
23.蒸发热(KJ/mol,b.p.):35.32
24.熔化热(KJ/kg):98.81
25.生成热(KJ/mol,气体):-201.39
26.生成热(KJ/mol,液体):-238.82
27.比热容(KJ/(kg·K),20ºC,定压):2.51
28.沸点上升常数:0.785
29.电导率(S/m,25ºC):1.5×10-9
30.热导率:0.0144(W/(m·K),0ºC),0.0222(W/(m·K),100ºC) [9]
31.体膨胀系数(K-1,20ºC):0.00119
32.体膨胀系数(K-1,55ºC):0.00124
33.相对密度(25℃,4℃):1.7866
34.相对密度(25℃,4℃):1.3265
35.临界密度(g·cm-3):0.273
36.临界体积(cm3·mol-1):117
37.临界压缩因子:0.223
38.偏心因子:0.566
39.Lennard-Jones参数(A):3.8632
40.Lennard-Jones参数(K):419.86
41.溶度参数(J·cm-3)0.5:29.532
42.van der Waals面积(cm2·mol-1):3.580×109
43.van der Waals体积(cm3·mol-1):21.710
44.气相标准燃烧热(焓)(kJ·mol-1):764.9
45.气相标准声称热(焓)( kJ·mol-1) :-201.5
46.气相标准熵(J·mol-1·K-1) :239.88
47.气相标准生成自由能( kJ·mol-1):-161.6
48.气相标准热熔(J·mol-1·K-1):44.06
49.液相标准燃烧热(焓)(kJ·mol-1):-726.9
50.液相标准声称热(焓)( kJ·mol-1):-239.1
51.液相标准熵(J·mol-1·K-1) :127.24
52.液相标准生成自由能( kJ·mol-1):-166.88
53.液相标准热熔(J·mol-1·K-1):81.4
化学性质
甲醇由甲基和羟基组成的,具有醇所具有的化学性质。
甲醇可以与氟气、氧气等气体发生反应,在纯氧中剧烈燃烧,生成水蒸气和二氧化碳
2CH3OH+3O2=2CO2+4H2O
而且,甲醇还可以发生氨化反应(370℃~420℃)
NH3+CH3OH→CH3NH2+H2O
NH3+2CH3OH→(CH3)2NH+2H2O
NH3+3CH3OH→(CH3)3N+3H2O
甲醇也可在空气中燃烧:
甲醇具有饱和一元醇的通性,由于只有一个碳原子,因此有其特有的反应。例如:
① 与氯化钙形成结晶状物质CaCl2·4CH3OH,与氧化钡形成BaO·2CH3OH的分子化合物并溶解于甲醇中;类似的化合物有MgCl2·6CH3OH、CuSO4·2CH3OH、CH3OK·CH3OH、AlCl3·4CH3OH、AlCl3·6CH3OH、AlCl3·10CH3OH等
4CH3OH+CaCl2→CaCl2·4CH3OH
2CH3OH+BaO→2CH3OH·BaO
② 与其他醇不同,由于-CH2OH基与氢结合,氧化时生成的甲酸进一步氧化为CO2
2CH3OH+O2→2HCHO+2H2O
2HCHO+O2→2HCOOH
2HCOOH+O2→2H2O+2CO2
③ 甲醇与氯、溴不易发生反应,但易与其水溶液作用,最初生成二氯甲醚(CH2Cl)2O,因水的作用转变成HCHO与HCl
2CH3OH+2Cl2=(CH2Cl)2O+H2O+2HCl
(CH2Cl)2O+H2O=2HCHO+2HCl
④ 与碱、石灰一起加热,产生氢气并生成甲酸钠
CH3OH+NaOH→HCOONa+2H2
⑤ 与锌粉一起蒸馏,发生分解,生成CO和H2O
分子结构数据
1.摩尔折射率:8.21
2.摩尔体积(cm3/mol):42.5
3.等张比容(90.2K):88.6
4.表面张力(dyne/cm):18.8
5.极化率(10-24cm3):3.25
计算化学数据
1.疏水参数计算参考值(XlogP):-0.5
2.氢键供体数量:1
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积20.2
7.重原子数量:2
8.表面电荷:0
9.复杂度:2
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
用途
1.基本有机原料之一,用于制造氯甲烷、甲胺和硫酸二甲酯等多种有机产品。也是农药(杀虫剂、杀螨剂)、医药(磺胺类、合霉素等)的原料,合成对苯二甲酸二甲酯、甲基丙烯酸甲酯和丙烯酸甲酯的原料之一。 [4]
2.甲醇的主要应用领域是生产甲醛,甲醛可用来生产胶粘剂,主要用于木材加工业,其次是用作模塑料、涂料、纺织物及纸张等的处理剂。
3.甲醇另一主要用途是生产醋酸。醋酸消费约占全球甲醇需求的7%,可生产醋酸乙烯、醋酸纤维和醋酸酯等,其需求与涂料、粘合剂和纺织等方面的需求密切相关。
4.甲醇可用于制造甲酸甲酯,甲酸甲酯可用于生产甲酸、甲酰胺和其他精细化工产品,还可用作杀虫剂、杀菌剂、熏蒸剂、烟草处理剂和汽油添加剂。
5.甲醇也可制造甲胺,甲胺是一种重要的脂肪胺,以液氮和甲醇为原料,可通过加工分立为一甲胺、二甲胺、三甲胺,是基本的化工原料之一。
6.甲醇可合成为碳酸二甲酯,是一种环保产品,应用于医药、农业和特种行业等。
7.甲醇可合成为乙二醇,是石化中间原料之一,可用于生产聚酯和防冻剂。
8.甲醇可用于制造生长促进剂。可以使作物大量增产,保持枝叶鲜嫩、茁壮茂盛、在夏天也不会枯萎,可大量减少灌溉用水,有利于旱地作物的生长。
9.甲醇可合成甲醇蛋白,以甲醇为原料经微生物发酵生产的甲醇蛋白被称为第二代单细胞蛋白,与天然蛋白相比,营养价值更高,粗蛋白含量比鱼粉和大豆高得多,而且含有丰富的氨基酸、矿物质和维生素,可以代替鱼粉、大豆、骨粉、肉类和脱脂奶粉。 [5]
10.甲醇用作清洗去油剂,MOS级主要用于分立器件,中、大规模集成电路,BV-Ⅲ级主要用于超大规模集成电路工艺技术。
11.用作分析试剂,如作溶剂、甲基化试剂、色谱分析试剂。还用于有机合成。
12.通常甲醇是一种比乙醇更好的溶剂,可以溶解许多无机盐。亦可掺入汽油作替代燃料使用。20世纪80年代以来,甲醇用于生产汽油辛烷值添加剂甲基叔丁基醚、甲醇汽油、甲醇燃料,以及甲醇蛋白等产品,促进了甲醇生产的发展和市场需要。
13.甲醇不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。甲醇与异丁烯反应得到MTBE(甲基叔丁基醚),它是高辛烷值无铅汽油添加剂,亦可用作溶剂。除此之外,还可制烯烃和丙烯,解决资源短缺问题。
14.甲醇可用于生产二甲醚,二甲醚除了在日用化工、制药、农药、染料、涂料等方面有广泛的用途,还具有方便清洁、十六烷值高、动力性能好、污染少。易加压为液体、易储存等燃料性能。甲醇和二甲醚按一定比例配制而成的新型液体燃料称为醇醚燃料。它的燃烧效率和热效率均高于液化气。
推荐文章
-
当全球动力电池市场迈入TWh时代,中国电池产业正以强劲的增长态势引领全球能源转型。 中汽协数据显示。2025年,1-10月,我国新能源汽车产销分别达到1301.5万辆和1294.3万辆,国内动力电池累计装车量578.0GWh,同时,新型储能装机规模超过1亿千瓦,已跃居世界第一,中国企业已成为全球清洁能源转型的核心引擎。 产业发展同时也伴随着诸多的产品安全问题,在规模红利逐渐见顶的当下,产业竞争迈入“技术创新深水区”,能量密度提升、安全性能强化、成本有效控制成为制约行业发展的核心瓶颈。 随着工信部推出新国标的实施(2027年6月),对电池品质和安全提到了新高度,可见竞争日趋激烈,如何共同维护健康有序的市场环境,如何创新引领技术进步。全球科研力量正加速集结攻关,科研创新已成为破解电池新能源产业困局的唯一路径,加大研发投入,补齐短板弱项,提升企业核心竞争力。 在这场全球技术竞赛中,一个融合中俄顶尖科研资源的新型研发机构-《浙江中俄工程技术研究院-长兴中俄新能源材料技术研究院》,正以其独具的优势在...
-
一、充电: 1、锂离子从正极脱出 充电前,锂离子嵌在正极材料的层状结构里,当电芯接入充电电路,电源对电芯施加外部电压,使正极材料中的锂离子获得能量,正负极之间产生电场,锂离子从正极材料中脱嵌而出,变成自由的锂离子和电子,电子通过外部回路流向负极,锂离子内部出现浓度梯度,使锂离子在活性颗粒中发生扩散(固相扩散过程) 2、锂离子穿过正极界面膜(CEI膜) CEI膜是由正极中的锂离子和电解液发生的副反应产生的化合物组成:首次充电时发生脱出并扩散过渡金属离子从正极溶解到电解液中,并由这些金属离子形成的产物也可以作为CEI膜重新沉淀到正极颗粒表面。CEI膜对正极会起到保护作用,阻碍正极和电解液的进一步反应,提高正极脱锂的稳定性。 CEI膜具有厚度薄、成分复合、生长不均匀、状态不稳定、化学性质特殊的特点。比如,CEI膜经常由磷酸锂(Li3PO4)、聚合物(例如聚丙烯腈)和锂盐(例如锂氟酸盐)组成。磷酸锂是CEI膜的主要框架材料,可以提供锂离子传输的通道,聚合物和锂盐则用于增加膜的电导率和降低界面阻抗。 3、锂离...
-
近日,圣彼得堡国立理工大学(SPbPU)与中国理工院校的合作交流迎来高光时刻。该校师生不仅在2025年遂宁国际锂电池产业大会上展现了深厚的学术实力,更在杭州国际创业大赛中斩获佳绩,为中俄科技创新与人才培养合作注入新动能。 聚焦锂电前沿,共话产业未来 2025年遂宁国际锂电池产业大会在四川遂宁隆重召开。作为全球锂电领域的重要盛会,本次大会吸引了来自中国、俄罗斯、德国、印度、澳大利亚等国的400余名顶尖高校、科研机构及企业代表参会。SPbPU派出以谢尔盖·康德拉季耶夫教授、王庆生院长为首的代表团及中俄新材料与新能源工程研究院(NEMTRI)团队出席,深度参与行业前沿对话。 在“准固态电池前景”专题研讨会上,王院长发表主旨报告,阐述了准固态电池技术的突破方向与产业化路径。他同时介绍了SPbPU与NEMTRI在新材料研发领域的合作进展,引发与会嘉宾广泛关注。值得一提的是,SPbPU多名毕业生及研究生在王庆生教授指导下,依托中国高校...